現在の医療は、高度な医療技術と医療装置に支えられている。機器の開発においても、最近の進歩には驚きを隠せない。
この章では、医用機器の安全に対しての機器製造業者の側から見た、安全対策について解説する。
3.1 機器の標準化
製造販売する製品の品質が一定レベル以上の性能を示し、安全であり、その製品の環境に与える影響が軽微であることが重要である。
また、国際化社会の下、各国間でこれらの基準が共用されている必要がある。
(1)グローバルスタンダード(国際標準:Global standard)
現在のように世界貿易が相互に盛んな状況下では、各国間で円滑に経済取引を行っていくには、相互理解、互換性の確保、消費者利益の確保のため、製品の規格が国際的に統一されていることが重要である。すなわち、製品の品質、性能、安全性、寸法、試験方法などに関して、国際的に取り決められていることが必要である。
この国際的な標準化のための組織として、ISOとIECが組織されている。
(2)ISO(国際標準化機構:International Organization for Standardization)
ISOは各国の代表的標準化機関から成る国際標準化機関で、電気及び電子技術分野を除く全産業分野(鉱工業、農業、医薬品等)に関する国際規格の作成を行っている。1947年に設立され、現在では147カ国が参加している。本部はスイスのジュネーブにある。ISOがIOSでないのは、ギリシャ語で平等を意味する“isos”という言葉が起源のためである。
(a)工業規格としてのISO
最近では、ISOというと品質保証や環境のマネジメント規格がクロズアップされているが、後述の電気及び電子技術分野の規格制定を行うIECが実施する分野を除く全産業分野(鉱工業、農業、医薬品等)に関する国際規格の作成を行っている。
ISOの規格は順次国内規格として1章で説明した、日本工業規格(JIS)として取り込まれる。
(b)ISOのマネジメントシステム
企業におけるマネジメントシステムとは、経営者が方針、目標を設定し、その目標を達成するための仕組みである。
ISOのマネジメントシステムには基本的には品質(ISO9001)と環境(ISO14001)およびその関連規格がある。
(イ)PDCAサイクル
企業経営におけるマネジメントシステムは、組織が自ら方針および目的を定め、その実現のための計画(Plan)を立て、それを実施及び運用(Do)し、その結果を点検及び是正(Check)し、さらに次のステップを目指した見直し(Act)を行うというシステムのことであり、これらの頭文字を採って、PDCAサイクルと呼び、このPDAサイクルを確立することが重要である。図表3-1にPDAサイクルを示す。
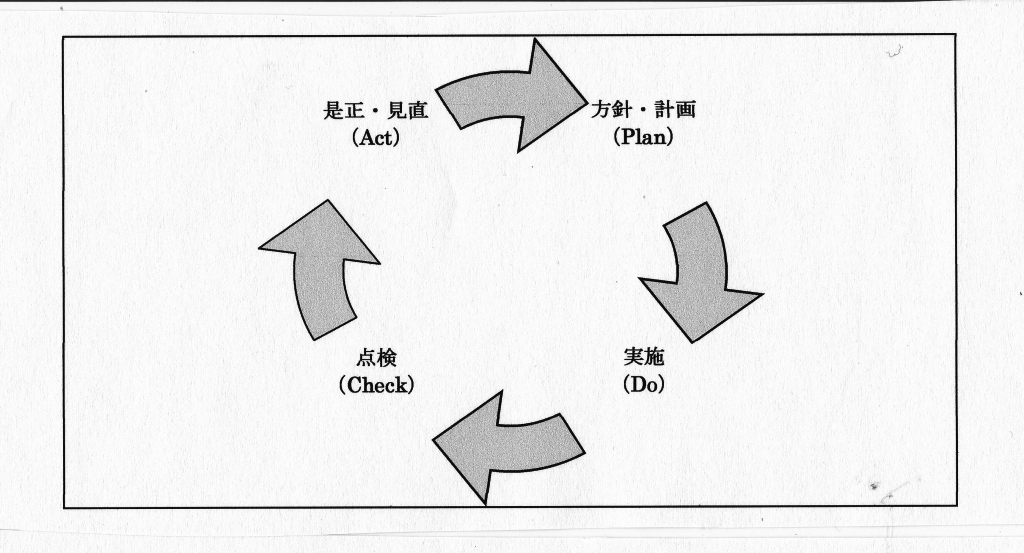
図表3-1 PDCAサイクル
(ロ)ISO9001
ISO9001は品質管理及び品質保証のための国際標準モデルとして1987年に制定された。2000年には大幅な改訂が行われ、品質マネジメントシステムとなった。
A. ISO9001の概要
ISO9001を通して、顧客満足の提供、改善活動の継続を実施することにより、社会的信用の維持と共に競争力の向上を通して企業価値の向上を目指すものである。
以前は顧客に信頼感を与える製品の品質管理に重点が有ったが、2000年の改定では、品質マネジメントに重点が置かれ、組織の質の向上を通しての顧客満足の実現に変更されている。
B. 品質マネージメントシステム(Quality Management System)
品質方針および品質目標を設定し、その目標を達成するためのシステムである。
具体的には、品質方針および品質目標を設定して、それに向かって活動し、結果として実績をチェックして対策を立て再び実行を繰り返すPDCAサイクルを継続的に運用し、目標の達成を目指すものである。
(ハ)ISO14001
1991年ISOに対して、環境についての国際標準化に取り組むよう要請が行われた。その背景には1980年代後半から、温暖化をはじめとする地球環境問題が世界的な関心事となってきたことが理由である。1992年、ブラジルに世界各国から首脳が集まり、地球サミット(国連環境開発会議)が開催され、この会議では、環境と開発に関するリオ宣言
アジェンダ21が採択され、人類の行動計画がまとめられた。
その具体的環境行動計画をフォローする目的で、環境マネジメントに関する一連の国際規格として制定されたものである。
A. ISO14001の概要
この規格は、ISO9001同様に個別の製品やサービス、について規定した規格ではなく、マネジメントシステム、つまり仕組みに関するものであり、環境保全への取り組みを体系的に進めるためのプロセスについて規定したものである。
したがって、エネルギー消費や環境汚染などに関して達成しなければならない水準を定めたものではない。
この規格は、各組織が自ら定めた環境方針を経済的、技術的に可能な範囲内で達成することによって、各々独自の方法で環境負荷の低減に自主的に取り組むことを求めたものである。
B. 環境マネジメントシステム(EMS: Environmental Management System)
ISO14001は、環境マネジメントシステムの仕様を定めた規格であり、ISO規格に沿った環境マネジメントシステムを構築する際に守らなければいけない事項が盛り込まれている。
PDCAサイクルによりよって、環境マネジメントシステムを継続的に向上させ、環境に与える有害な負荷を減少させることをねらいとしている。
このように各組織が自ら定めた環境方針を経済的、技術的に可能な範囲内で達成することによって、各々に独自の方法で環境負荷の低減に自主的に取り組む事を求めており、環境活動に関する具体的な数値等を求めておらず、当然罰則等は無い。
ISO14001に法的拘束力は無く、環境活動に関する具体的な数値等を求めている訳では無い。環境問題に取り組む管理体制を持つことで、環境法規制を遵守すること、環境目的と目標を達成するための仕組みを運用すること、絶え間なく改善を続けていくことなど事業者の経営面での管理手法について定めているものであり、環境マネジメントに取り組むことは、省資源や省エネルギーを通じて、経費節減につながり、また、企業内部の管理体制の効率化につながる効果がある。このように環境問題に積極的に取り組んでいると言うイメージ以外にも多くのメリットが期待できる。
これらの取り組みの成果は、審査機関の審査を受けて認証を取得することも可能である。
(3)IEC(国際電気標準会議:International Electrotechnical Commission
IECは電気技術に関する全ての分野を包括し、国際規格や標準を作成する各国の代表的標準化機関(日本は経済産業省産業技術環境局)から成る国際標準化機関であり、電気及び電子技術分野の国際規格の作成を行っている。
設立は1906年で、日本が正式加盟したのは1910年、今や全世界人口の80%をカバーすると言われている。
A. ISOとIECの関係
IECとISOは密接な協力関係にある。1976年に結ばれた協定では、それぞれの責任をIECは電気工学と電子工学の分野を扱い、ほかの分野はすべてISOが扱うと定めている。現在では、ISOとIECの共通専門委員会であるJTC1(Joint
Technical Committee1:情報技術専門委員会)があり、相互の作業手順がIEC/ISO Directive,規格に関連した項目を補足する多くのガイドがISO/IEC Guideとして共通に発行され、両者の規格制定過程に至るまでの協調関係が進展している。
共同の作業プログラムが設けられ、効率のよい国際規格の開発が保証される。両機関の中央事務局はともにジュネーブの同じ建物にあり、協調関係は良好である。
B. IECの目的
IECの目的は、加盟各国のコンセンサスに基づく国際電気標準規格の作成と規格に適合した製品の品質と安全性を保証することである。
3.2 医用機器の規格
近年、医療機関における医療事故が相次ぎ、医療に対する国民の信頼が揺らぎかねない状況となっており、医療機関における安全の確保が緊要な課題の一つとなっている。このような状況下、医療に使用される機器は一般工業機器とは異なり、生体に対する電気的安全性などについて特に厳しい条件が付けられている。
電気的安全を含め、すべての医用機器、システム、医療用具の生産、流通に関しては厚生労働省の薬事法に基づく許認可が必要である。
(1)医用機器安全規格の概要
上述のように医用機器の流通には、日本では薬事法、米国ではFDAの許可、欧州ではEC 指令の遵守が義務付けられている。
基本的には電気的安全性とEMCに対する安全対策が主体となっている。
(イ)医用電気機器のクラス分け
電気的なリスクに応じてクラス分けが実施される。IEC規格でのクラス分けを図表3-2に示す。

図表3-2 医用機器のクラス分け
(ロ)EMC(Electro-Magnetic Compatilibility:電磁環境両立性)
電磁妨害すなわち、装置から意図しない不要電磁波を出さない(EMI:Electro Magnetic Interference)と電磁波を受けても誤動作を起こさない電磁感受性(EMS:Electro- Magnetic Susceptance)
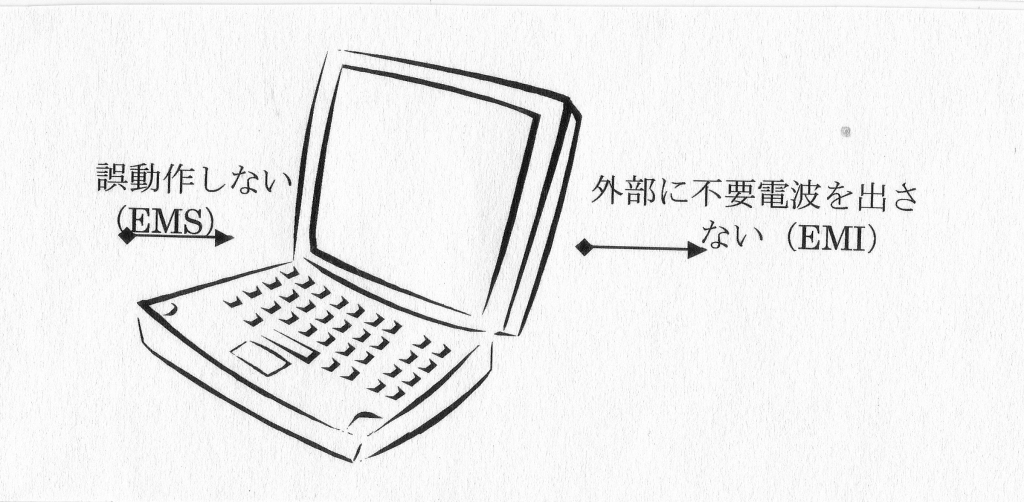
図表3-3 EMCの概念図
(2)各種規格の状況
医用規格には、各国独自の規格が制定されているが、国際的に統一する方向性は明らかである。
(イ)日本
薬事法で定められているが、IEC規格に準拠した日本工業規格(JIS)に定められた項目を順次採用している。
(ロ)EC
ECに属する国では、EC 指令に従う必要がある。EC 指令とはEC理事会が制定した指令であり、欧州市場に出る製品に均一な安全性を要求している。
EU加盟国政府は自国の法令をEC指令に整合するよう変更しなければならない。
全製品に共通する広範囲の指令と個別対象製品別の指令があるが、ISO/IECの規格に順次採用される内容と同じである。
(ハ)米国
米国における医用機器は日本の薬事に相当する、FDAと電器安全に関するUL規格がある。歴史の違いからIECと異なる点がある。
A.FDA(Food and Drug Administration:食品医薬品局)
FDAでは食品や医薬品、化粧品、医療機器、動物薬など消費者が通常の生活を行うに当たって接する機会のある製品について、その許可や違反品の取締りなどの行政を専門的に行う政府機関であり、HHS
(Department of Health and Human Services保険社会福祉省)に属する。FDAの許可が無ければ米国での医用機器の販売活動は出来ない。
B. UL(Underwriters Laboratories Inc.)規格
ULは1894年米国の火災保険会社の協会である全 国火災保険業者会議により設立された非営利団体である。ULの設立は、火災から消費 者を守ることに狙いがあったが、同時に火災保険業者の自衛手段でもあった。
現在では保険業者のみならず、米国、連邦政府、州政府、等各種機関がUL規格を採 用しており、火災、盗難、その他の事故から、人名、財産を安全に保護するため、製
造者の依頼により、材料、部品などの試験を行い、規格に合致したものについてラベ ルその他の表示の権利を与えており、病院での使用機器にはUL取得が必要である。カナダにおいては同種規格CSA(Canadian
Standards Association)がある。
